
مجموعه ای از تحقیقات جدید برای مطالعه
به قلم دکتر فاطمه سفیدکن، استاد مؤسسه تحقیقات جنگلها و مراتع کشور
۱۷ اسفند ۱۳۹۸
این روزها شیوع ویروس کرونا در کشور و نگرانی بابت ابتلا، نحوه درمان و کنترل آن موجی را به راه انداخته است که افراد مختلف نوشتههای درست و غلطی را در شبکه های مجازی ارسال کرده و بیم و امیدهایی را در دل مردم پدید میآورند که بسیاری از آنها مبنای علمی درستی ندارند. به عنوان حداقل وظیفه خودم، برخی از آخرین تحقیقات شیمی دنیا را در مورد این ویروس جمعآوری کرده و در این مقاله برای مطالعه بیشتر ارائه می کنم.
به برخی از این منابع در آخرین شماره نشریه ACS از انجمن شیمی دانان آمریکا (American Chemical Society) اشاره شده است. قابل ذکر است که سازمان بهداشت جهانی در ۱۱ فوریه ۲۰۲۰، نام رسمی بیماری ناشی از بیماری کرونا را کووید-۱۹ (COVID-19) اعلام کرد.
کرونا ویروسها خانواده بزرگی از ویروسها هستند که می توانند باعث ایجاد بیماری تنفسی، از جمله سرماخوردگی و گاه بیماریهای جدیتر مانند سندرم تنفسی خاورمیانه (MERS) و سندرم شدید تنفسی حاد (SARS) در انسان شوند. این گروه از ویروسها همچنین می توانند حیوانات را آلوده کرده و بین حیوانات و انسان ها منتقل شوند.
در حقیقت، برخی از گونههای حیوانی مثل خفاشها به عنوان منبعی برای حمل انواع ویروسها عمل میکنند و در هنگام تماس نزدیک انسان با این حیوانات امکان انتقال ویروس از حیوان به انسان بوجود میآید (مانند شیوع ویروسهای SARS و MERS در گذشته). کرونا ویروس جدید (که در حال حاضر با عنوان ۲۰۱۹-nCoV نیز شناخته می شود) برای اولین بار در دسامبر سال ۲۰۱۹ در ووهان چین کشف شد و به نظر میرسد در ابتدا افرادی را که از یک بازار فروش غذاهای دریایی و حیوانات زنده بازدید کرده بودند، تحت تأثیر قرار داد و سپس ویروس شخص به شخص منتقل شده و گسترش پیدا کرد. تحقیقات در مورد منبع این ویروس به موازات نحوه انتقال و کنترل آن فعالانه در حال انجام و پیشرفت است. آخرین اطلاعات به روز را میتوانید از سایت https://www.cdc.gov/coronavirus/2019-ncov/about/index.html مطالعه کنید.
علم شیمی در فهم همه چیز از ساختار ویروسی گرفته تا پاتوژنز، جداسازی واکسن و روشهای درمانی و همچنین در ساخت مواد و تکنیکهای مورد استفاده برای محققان علوم پایه، ویروس شناسان و پزشکان نقش اساسی دارد. در آخرین شماره نشریه ACS از انجمن شیمی دانان آمریکا، سردبیر بخش زیست شناسی (ACS Chemical Biology) نشریه (Laura Kiessling) می گوید: “تحقیقات بنیادی برای شناخت مولکولهایی که بر ساختار و عملکرد ویروس حاکم هستند میتوانند کشف ابزار لازم برای درمان و جلوگیری از بیماریهای عفونی را تسریع کنند. رویدادهایی مانند شیوع ویروس کنونی کرونا، ضرورت تحقیقات بنیادی و نیاز به بودجه تحقیقاتی پایدار را برجسته میکند ، به طوری که در صورت نیاز به پاسخ سریع ، منابع علمی جامع وجود داشته باشد. “
ساختار ویروس کرونا و مکانیسم ایجاد عفونت
دانشمندان به سرعت در توصیف کووید-۱۹ حرکت کرده و یافتههای تحقیقاتی خود را در بین جامعه بین المللی محققان در اسرع وقت به اشتراک میگذارند. یک نمونه مهم از این تحقیقات، مدلهای همسانی سیستئین پروتئاز کروناویروس جدید است.
دسترسی سریع به دادههای ژنومی کرونا، تولید مدلهای همولوگ نسل اول برای ۳CLpro سیستئین پروتئاز را ممکن ساخت. آنزیمی که برای تکثیر ویروسی بسیار مهم است و قبلاً به عنوان هدف درمانهای ضد ویروسی در معالجه SARS به عنوان یک کروناویروس دیگر مورد بررسی قرار گرفته بود. این نسخه نشان میدهد که اگرچه ژنوم ویروسی شباهت نزدیکی با کرونا ویروسهای خفاش دارد، اما پروتئاز با نزدیکترین همسانی با پروتئاز کرونا ویروس SARS نشان میدهد این ویروس از طریق حیوان دیگری (civets) وارد جمعیت انسان شده است (https://www.cdc.gov/sars/media/civet-ban.html).
Huang و همکاران (۲۰۱۶) از روشهای کریستالوگرافی و بیوفیزیکی برای تشخیص خصوصیات ساختاری و عملکردی HKU9-RBD (کرونا ویروس خفاش که به انسان منتقل نشده است) استفاده کردند. دلیل اصلی این مطالعات این بود که بتا-کروناویروس (نوعی که شامل SARS و MERS است) باید در صورتی که منجر به همه گیری جهانی بعدی شوند ، به خوبی مشخص شود. پس از مقایسه دامنه اتصال دهنده –گیرنده (RBD) این ویروس با ساختارهای موجود SARS ، MERS و HKU4 (یک کرونا ویروس دیگر از خفاش)، مشخص شد که شناخت دهنده-گیرنده ها با وجود دانش موجود از تاریخچه تکاملی ویروسهای RNA دشوار است. در این مطالعه ویروسهای کرونا چندین مدل ساختاری را در زیرگروه خاصی از پروتئین ها به نام spike protein نشان دادند. مطالعات اخیر نشان داده که کرونا ویروس کووید-۱۹ نیز از همین گروه پروتئینهاست (شکل ۱)
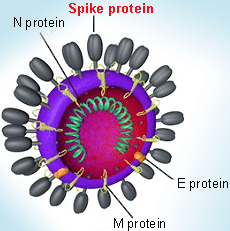
شکل ۱- تصویری از پروتئینهای میلهای (spike protein) ویروس کرونا
پروتئینهای میلهای (spike protein) که در سطح ویروس وجود دارند، یک عامل کلیدی در تشخیص گیرندهها بوده و به عنوان بخشی از مکانیسم نفوذ غشایی و ایجاد عفونت نقش دارند. محققان دریافتهاند که پروتئین S از بتا-کرونا ویروسها از یک جد مشترک منشاء گرفته و در منطقه خارجی RBD تکامل می یابند و این تعیین کننده پتانسیل ویروس برای انتقال بین گونههای مختلف است.
Lee و همکاران (۲۰۱۵) بیش از ۲۵،۰۰۰ ترکیب را برای یافتن یک مولکول کوچک مهار کننده دوگانه برای آنزیم های پروتئاز شبه پاپائین (PLpro) از کرونا ویروسهای MERS و SARS غربالگری کردند و توانستند یک ترکیب با فعالیت مهاری در برابر هر دو آنزیم شناسایی کنند. نکته جالب توجه این است که با وجود این واقعیت که این دو آنزیم در ساختار کلی و سایت های کاتالیزوری خود شباهت های قابل توجهی دارند، ترکیب شناسایی شده به عنوان یک مهار کننده رقابتی در برابرکرونا ویروس MERSعمل میکند، در حالیکه در مقابل کرونا ویروس SARS به عنوان یک مهارکننده آلوستریک (allosteric) عمل میکند. بعلاوه، اگرچه ویژگی بازدارندگی ترکیب ممکن است برای این دو نوع ویروس متفاوت باشد، بازدارنده برای هر دوی اینها بیش از دو همولوگ انسانی انتخابی بود. با وجود اینکه، هیچکدام از چهار مهارکننده سرب آزمایش شده روی کرونا ویروس SARS در برابر MERS مؤثر نبودند، یک مهارکننده با عملکرد دوگانه برای هر دو پروتئازهای شبه پاپائین برای SARS و MER شناسایی شد.
روشهای درمانی
تحقیقات وسیعی برای یافتن داروهای ضد عفونی کننده برای کروناویروسهای شناخته شده قبلی و همچنین ۲۰۱۹-nCoV در جریان است. مطالعه مروری توسط Morse و همکاران (۲۰۲۰) در مورد گزینه های پیشگیری و درمان احتمالی برای ۲۰۱۹-nCoV بحث میکند. چهار آنزیم مهم وجود دارد که حضور آنها برای پاتوژنز ضروری است: پروتئین میلهای که ورود ویروس را از طریق آنزیم تبدیل کننده آنژیوتانسین ۲ به گیرنده سطح سلول میزبان تسهیل میکند، پروتئاز اصلی کروناویروس ۳CLpro و پروتئاز شبه پاپایین (PLpro) که در مونتاژ ویروسهای جدید نقش دارند و همچنین RNA وابسته به RNA پلیمراز (RdRp) که تکثیر ژنوم کروناویروس RNA را تسهیل میکند (https://chemrxiv.org/articles).
نویسندگان استدلال میکنند که اختلاف بین پروتئین میلهای کووید-۱۹ با SARS احتمالاً نیاز به توسعه درمانهای جدید دارد. توالی آنزیمهای PLpro هر دو ویروس ۸۳٪ مشترک هستند اما در اجزای سازه اصلی ثانویه آنها که سایتهای فعال آنها را تشکیل میدهند تفاوت ندارند. از این رو، مهارکنندههای پیشرفته برای SARS ممکن است در برابر آنزیم ۲۰۱۹-nCoV فعال باشند. ۲۰۱۹-nCoV و SARS RdRp و ۳CLpro از نظر توالی دارای اشتراک قابلتوجهی هستند و این باعث میشود کاربرد مولکولهای کوچک دارویی که قبلاً بر اساس پروتئینهای SARS-CoV تهیه شده بودند، مانند Remdesivir و ۳LCpro-1، را برای درمان این کرونا ویروس جدید امکان پذیر نماید.
یک بررسی عمومی تر توسط Falcinelli و همکاران (۲۰۱۶) اهمیت تحقیقات بالینی و بنیاذی را به صورت همزمان برای بررسی پاتوژنهای ویروسی و توسعه درمان های جدید ارائه می دهد. چشم انداز Pillaiyar و همکاران (۲۰۱۶) ارائه یک مرور کلی از شیمی درمانی در برابر پروتئاز کرونا ویروس SARS بین سال ۲۰۰۳ (هنگامی که شیوع SARS رخ داده است) و ۲۰۱۵ ارائه میدهد.
Mehellou و همکاران (۲۰۱۸) به بررسی فنآوری پروتید (ProTide) در در درمان بیماری پرداختند. رویکردی که تحویل داخل سلولی مونوفسفاتهای آنالوگ نوکلئوزید و مونوفسفاتها را تسهیل می کند. پروتید GS-5734 تولید شده توسط آکادمی علوم Gilead در برابر طیف گسترده ای از ویروسها، از جمله کرونا ویروسها فعال بود. Schor و Einav (2018) در مورد استفاده از داروهای موجود به عنوان عوامل گسترده طیفی برای درمان پاتوژنهای داخل سلولی بحث می کنند و خاطرنشان می کنند که مهار کننده های کیناز مانند ایماتینیب و نیلوتینیب کرونا ویروس هایی مانند SARS و MERS را مهار می کنند. مقاله ای که در اخبار شیمی و مهندسی شیمی منتشر شده است از تلاشهای شرکتهای دارویی و شرکتهای بیوتکنولوژی برای توسعه روشهای سریع تشخیص و درمان برای ۲۰۱۹-CoV حکایت دارد (Jarvis, 2020).
بررسی یک مقاله پژوهشی توسط Wang و همکاران (۲۰۱۶) نشان می دهد که یک استراتژی برای غلبه بر این بیماری تهیه واکسن ضد SARS است که شامل هدف قرار دادن یک اپی توپ خاص از پروتئین میلهای ویروس است. یون و همکاران (۲۰۱۹) سنتز آنالوگهای آریسترومایسین را به عنوان ترکیبات ضد ویروسی گزارش کردند که قادر به مهار پروتئیناز RdRp از ویروسهای مختلف RNA و سلول میزبان S-adenosyl-L-homocysteine hydrolase. بودند. دو مقاله توسط کی لیو و همکاران (۲۰۱۸) مهارکننده های فیوژن ویروسی را در برابر کروناویروس MERS ارائه می دهند.
Kvach و همکاران (۲۰۱۹) گزارش توسعه اولین مهارکننده های شبه APOBEC3 را به عنوان راهکاری برای تقویت درمان های ضد ویروسی (و ضد سرطان) معرفی کردند. APOBEC3 ، آنزیمی که جزئی از سیستم ایمنی ذاتی بدن است، با تغییر ماده ژنتیکی مشتق از پاتوژن، دفاع مؤثر را در برابر عفونت ویروسی انجام داده و از این طریق ویروس را ناکارا می کند.
با بهره گیری از شباهت ها در مورفولوژی مکانهای فعال در پروتئازهای اصلی و ۳C کرونا ویروسها و انتروویروسها، Zhan و همکاران (۲۰۲۰)، آنتی ویروسهای گسترده طیفی را تحت عنوان مهارکننده های پپتیدومیمیک a-ketoamides طراحی، سنتز و توصیف کرده اند. ارزیابی ترکیبات سرب در برابر پروتئازهای نوترکیب، در تکثیر ویروسی و در سلولهای آلوده به ویروس منجر به کشف ترکیب ۱۱r شده که فعالیت قوی ضد کروناویروس MERS در سلولهای کبد انسان را نشان می دهد. با توجه به شباهت های به نمایش گذاشته شده توسط پروتئازهای کروناویروس MERS و کووید-۱۹، نویسندگان پیشنهاد می کنند که ترکیب ۱۱r احتمالاً در برابر COVID-19 نیز فعال است.
References:
– Falcinelli, S.D., Chertow, D.S. and Kindrachuk, J., 2016. Integration of Global Analyses of Host Molecular Responses with Clinical Data to Evaluate Pathogenesis and Advance Therapies for Emerging and Re-emerging Viral Infections. ACS Infect. Dis. 2, 11, 787-799.
– Huang, C., Qi, J., Lu, G., Wang, O., Yuan, Y., Wu, Y., Zhang, Y., Yan, J. and Gao, G.F., 2016. Putative Receptor Binding Domain of Bat-Derived Coronavirus HKU9 Spike Protein: Evolution of Betacoronavirus Receptor Binding Motifs. Biochemistry, 55, 43, 5977-5988.
– Jarvis, L.M., 2020. Drug firms mobilize to combat novel coronavirus outbreak. Development of diagnostics, vaccines, and treatments is underway. In press (JANUARY 30, 2020 | APPEARED IN VOLUME 98), ISSUE 5 ().
– Kvach, M.V., Barzak. F.M., Harjes, S., Schares, H.A.M., Jameson, G.B., Ayoub, A.M., Moorthy, R., Aihara, H., Harris, R.S., Filichev, V.V., Harki, D.A. and Harjes, E., 2019.Inhibiting APOBEC3 Activity with Single-Stranded DNA Containing 2′-Deoxyzebularine Analogues. Biochemistry, 58, 5, 391-400.
– Lee, H., Lei, H., Santarsiero, B.D., Gatuz, J.L., Cao, S., Rice, A.J., Patel, K., Szypulinski, M.Z., Ojeda, I., Ghosh, A.K. and Johnson, M.E., 2015. Inhibitor Recognition Specificity of MERS-CoV Papain-like Protease May Differ from That of SARS-CoV. ACS Chem. Biol., 10, 6, 1456-1465.
– Mehellou, Y., Rattan, H.S. and Balzarini, J., 2018. The ProTide Prodrug Technology: From the Concept to the Clinic, Miniperspective. J. Med. Chem., 61, 6, 2211-2226.
– Pillaiyar, T., Manickam, M., Namasivayam, V., Hayashi, Y. and Jung, S.H., 2016. An Overview of Severe Acute Respiratory Syndrome–Coronavirus (SARS-CoV) 3CL Protease Inhibitors: Peptidomimetics and Small Molecule Chemotherapy. J. Med. Chem. 59, 14, 6595-6628.
– Qidi Wang, O., Zhang, L., Kuwahara, K., Li, L., Liu, Z., Li, T., Zhu, H., Liu, J., Xu, Y., Xie, J., Morioka, H., Sakaguchi, N., Qin, C. and Liu, G., 2016. Immunodominant SARS Coronavirus Epitopes in Humans Elicited both Enhancing and Neutralizing Effects on Infection in Non-human Primates. ACS Infect. Dis., 2, 5, 361-37.
– Schor, S. and Einav, S., 2018. Combating Intracellular Pathogens with Repurposed Host-Targeted Drugs. ACS Infect. Dis., 4, 2, 88-92.
– Wang, C., Xia, S., Zhang, P., Zhang, T., Wang, W., Tian, Y., Meng, G., Jiang, S. and Liu, K., 2016. Discovery of Hydrocarbon-Stapled Short α-Helical Peptides as Promising Middle East Respiratory Syndrome Coronavirus (MERS-CoV) Fusion Inhibitors. Med. Chem., 61, 5, 2018-2026.
– Wang, C., Zhao, L., Xia, S., Zhang, T., Cao, R., Liang, G., Li, Y., Meng, G., Wang, W., Shi, W., Zhong, W., Jiang, S. and Liu, K., 2018. De Novo Design of α-Helical Lipopeptides Targeting Viral Fusion Proteins: A Promising Strategy for Relatively Broad-Spectrum Antiviral Drug Discovery. J. Med. Chem., 61, 19, 8734-8745.
– Yoon, J.S., Kim, G., Jarhad, D.B., Kim, H.R., Shin, Y.S., Qu, S., Sahu, P.K., Kim, H.O., Lee, H.W., Wang, S.B., Kong, Y.J., Chang, T.S., Ogando, N.S., Kovacikova, K., Snijder, E.J., Posthuma, C.C., Hemert, M.J. and Jeong, L.S., 2019 Design, Synthesis, and Anti-RNA Virus Activity of 6′-Fluorinated-Aristeromycin Analogues. J. Med. Chem., 62, 13, 6346-6362.
– Zhang, L., Lin, D., Kusov, Y., Nian, Y., Ma, O., Wang, J., Brunn, A., Leyssen, P., Lanko, K., Neyts, J., Wilde, E., Snijder, E.J., Liu, H. and Hilgenfeld, R.,2020. α-Ketoamides as Broad-Spectrum Inhibitors of Coronavirus and Enterovirus Replication: Structure-Based Design, Synthesis, and Activity Assessment. J. Med. Chem. 2020, XXXX, XXX, XXX





